
产品货号:
HR8803
中文名称:
红细胞活性氧检测试剂盒
英文名称:
Red blood cell Total ROS Assay Kit
产品规格:
100T|200T
发货周期:
1~3天
产品价格:
询价
本制品是一种利用新型荧光探针BalBoxiProbe O06进行红细胞活性氧检测的试剂盒。本试剂盒中的BalBoxiProbe O06 ROS探针为绿色荧光的活性氧探针,具有488nm/510nm的最大激发/发射波长。

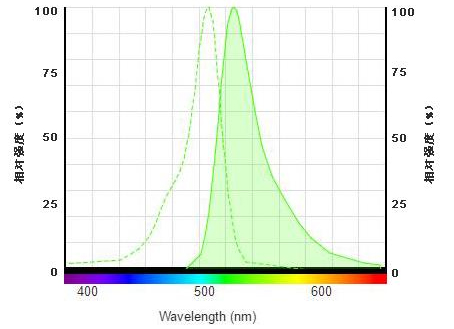

BalBoxiProbe O06 ROS探针在红细胞中活性氧存在的条件下,被氧化生成绿色荧光物质,绿色荧光强度与红细胞内活性氧水平成正比,检测O06产物的荧光强度就可以知道红细胞内活性氧的水平。在激发波长488nm,发射波长510nm附近,使用荧光分光光度计、荧光酶标仪、荧光显微镜、激光共聚焦显微镜、流式细胞仪等检测O06产物的荧光强度,从而测定红细胞内活性氧水平。

- 使用方便:可用荧光分光光度计、荧光酶标仪或流式细胞仪检测或激光共聚焦显微镜直接拍照分析;
- 背景低,灵敏度高;
- 线性范围宽,使用方便。

- 荧光分光光度计
- 荧光酶标仪
- 流式细胞仪
- 荧光显微镜
- 激光共聚焦

| 组分 | 100T | 200T |
| BalBoxiProbe O06荧光探针 | 100μL | 200μL |
| 说明书 | 1份 | 1份 |
保存:-20℃,有效期6个月。

- 探针长期不用可以-20℃保存。
- 避免反复冻融。
- 可以根据需要分装后冻存。
- 探针液A为DMSO溶液,冬季气温较低时为凝固状态,极易粘附在管壁、吸头壁。注意需要加热融解,变成液体状态后离心至管底部再开盖。
- 可以用手捂住使其融解或37℃短时间水浴。吸头也需要放在培养箱预热,否者容易再次凝固在吸头内壁产生损耗。
- 有效期为试剂盒未拆封前按要求条件保存的有效期。试剂拆封后请尽快使用完!

| 仪器准备 |
|
| 试剂准备 |
|
| 耗材准备 |
|

- 螺旋盖微量试剂管装的试剂在开盖前请短暂离心,将盖内壁上的液体收集至管底,避免开盖时液体洒落。
- BalBoxiProbe O06荧光探针在2~8℃时是固体状态,从冰箱取出后恢复至室温,变成液体状态后离心至管底部再开盖。
- 本荧光探针在冬季气温较低时在室内时为凝固状态,极易粘附在管壁、吸头壁。注意需要加热溶解,吸头也需要放在培养箱预热,否者容易再次凝固在吸头内壁产生损耗。
- 使用前,先将本品取出回温至室温(20℃以上),并对其进行简短离心使溶液集中于管底。
- 荧光探针标记后,一定要洗净残余的未进入细胞内的探针,否则会导致背景较高。
- 探针标记完毕并洗净残余探针后,可以进行激发波长的扫描和发射波长的扫描,以确认探针的标记情况是否正常。
- 尽量缩短探针标记后到测定所用的时间,以减少各种可能的误差。
- 探针标记的时间也可以根据情况在15~60分钟内适当进行调整。
- 必须使用荧光检测专用的黑色96孔板。

- 探针染色工作液配制:
根据样本数量,用HBSS将BalBoxiProbe O06荧光染料1000~2000倍稀释,配制成探针染色工作液。- 建议收到产品后,根据单次使用量,对母液进行小量分装,每次使用一管,试剂-20℃避光冻存,一年稳定。
- 开始实验前,使用HBSS缓冲液或PBS稀释储存液到需要的工作浓度。工作浓度为根据不同细胞的预实验结果确定的最佳工作浓度,一般染色终浓度1000~5000倍稀释。1000倍稀释适合大多数细胞样本的检测。
- 为了降低过度加载染料导致的潜在背景和细胞毒性,在不影响实验结果的前提下应尽可能低浓度染色。另外,浓度过高也可能造成非特异性染色。
- 不可以使用含血清培养基稀释探针。
- 工作液现配现用。
- 以下步骤使用的探针为此步骤配置好的探针工作液。
- 建议收到产品后,根据单次使用量,对母液进行小量分装,每次使用一管,试剂-20℃避光冻存,一年稳定。
- 探针标记:
- 离心,吸除上清培养基。
- 用PBS洗细胞一次。
- 细胞收集后重悬浮于稀释好的37℃预热的O06探针工作液中,细胞浓度为1×106~2×107/毫升。
- 于37℃细胞培养箱内避光孵育20~45分钟。每隔3~5分钟颠倒混匀一下,使探针和细胞充分接触。
- 离心,吸除染色液,加入PBS(pH7.4)重悬细胞,洗涤3次。以充分去除未进入细胞内的O06探针。
- 用HBSS/PBS重悬细胞。
- 用荧光光度计、荧光酶标仪、流式细胞仪检测。最大激发/发射波长为488nm/510nm。
- 对于悬浮细胞,也可将细胞贴附于经细胞粘合剂处理过的盖玻片上,然后使用类似于贴壁细胞的方法进行染色。
- 如果需要盖玻片上固定化的细胞,那么可在铺片前可以先用多聚赖氨酸(poly-D-lysine)包被载玻片或盖玻片。
- 若染色不够充分,建议增加染料浓度或延长染色时间。
- 离心,吸除上清培养基。
- 活性氧检测:
- 收集细胞后标记探针然后用荧光分光光度计、荧光酶标仪或流式细胞仪检测。
- 对于收集细胞后标记探针的样品可以用荧光分光光度计、荧光酶标仪或流式细胞仪检测,用激光共聚焦显微镜直接拍照分析也可以(需要有相关的荧光强度分析软件)。
- 使用488nm激发波长,510nm发射波长,实时或逐时间点检测刺激前后荧光的强弱。
- 荧光强度强,活性氧含量高。
- 如果用显微镜拍照分析的话,需要细胞分布均匀。
- 收集细胞后标记探针然后用荧光分光光度计、荧光酶标仪或流式细胞仪检测。

- 活性氧结果如何分析?
ROS是多种物质的统称,不像某一单一活性氧指标,无法检测其绝对的含量,只能通过设置参照样本,以参照样本的倍数来反映目标样本相对含量变化,这个“相对”是针对参照的。分析结果是定性的,也是没有单位的,因为它本质上是一个比值(目标/参照)。反映的是模型样本通过具体的干预措施(如养分缺失、缺氧、药物治疗或遗传基因操控等)如何影响其ROS的变化,测定其ROS是增加或者降低了。 - 荧光照片如何分析?
需要有相关的荧光强度分析软件。ROS表达水平直接通过荧光信号的强弱和分布范围来体现。
有的显微镜扫描下来的图像本身就可以测面积和强度,可以同时测不同颜色的荧光强度。有的显微镜不支持此功能,可以将荧光染色彩色图像转换为黑白的灰度图,然后再以灰度值作为测量指标进行分析。
要结合明场的照片具体分析。如果细胞分布均匀可以算固定面积荧光强度。成像时中心和四周有差异时,一般将四周剪切掉也可以。如果细胞分布不匀,需要找到细胞分布匀称的视野,一个视野一个视野找。
如果要用图片做结果,就要平行做多个图片,作分析,统计,每张都要求荧光分布尽量一致。
为了去除杂光的影响,可以适当调节统计荧光的强度范围,将信号过弱的背景杂光去除掉。对照组和实验组整张图片需要做同样的处理,保证所有参数均要一致。对于不同情况荧光强度的统计方法,根据实验需要或参考文献。可以算等面积的平均强度;也可以算阈值高于一定值的平均强度;也可以算荧光的累积而不算平均。
要根据课题需要选择合适的测量统计方法。 - 荧光照片效果不好?
荧光拍照存在很多变量,每一个变量都会严重影响拍照效果。
荧光拍摄条件:拍摄环境、显微镜品牌和激发荧光决定了镜下观察的效果。同样的操作方法和切片,在不同品牌显微镜下显示出完全不同的荧光强度。
荧光衰减:荧光物质的衰减通常都是非常明显的。同样的一组切片,1小时内拍摄和8小时后拍摄,荧光效果完全不同。
最好用激光共聚焦显微镜,激光共聚焦显微镜的分辨率比普通荧光显微镜要高的多,通常同一张片子激光共聚焦的效果明显更优。 - 背景荧光比较高?
在没有细胞外酯酶和其他氧化酶的情况下,荧光随时间的逐渐增加可能是来自自发水解,导致水解的原因可能与大气氧化或光诱导氧化有关。 - 荧光强度在变化?
可以观察到荧光的逐渐增加(由于自动氧化)或减少(由于细胞中的染料损失或光漂白)。在没有任何刺激或诱导的情况下,健康的未经处理的细胞中的荧光突发可以指示细胞死亡或一些其他氧化事件的进展。
相关搜索:红细胞活性氧检测试剂盒,红细胞活性氧检测,红细胞ROS检测,RBC活性氧检测,Red blood cell Total ROS Assay Kit



